Einführung in die Ökotoxikologie
anhand des Elodea-Biotests
Dieses Dokument bringt allen Interessierten Ideen und Konzepte der Ökotoxikologie näher, ohne dabei mit unnötigem Fachvokabular das Verständnis zu verbauen. Nach einer allgemeinen Einführung wird ausführlich bebildert ein eleganter Versuch (Biotest) beschrieben, der ohne viel Aufwand selbständig zu Hause oder in Gruppen in der Schule (8. bis 13. Klasse) durchgeführt werden kann. Dabei ist Einleitung, Versuchsaufbau und Diskussion nat¸rlich nur als Vorschlag zu sehen und kann sicherlich an der einen oder anderen Stelle erg”nzt und verbessert werden. Im Anhang befinden sich neben weiterführender Literatur auch Grafikvorlagen für Overheadprojektoren.
Das Konzept ist erweiterbar, denkbar wäre u.a. ein Biotest verschiedener Substanzen im Rahmen einer Facharbeit oder Projektwoche. Die Basis der naturwissenschaftlichen Erkenntnisgewinnung, der Versuch, läßt sich in selbstständiger Arbeit schrittweise erschließen.
Der Versuch im Sommer 1994 wurde im Rahmen des limnologischen Großpraktikums der Aquatischen Ökologie, Universität München durchgeführt.
Meine eMail lautet: florian@burckhardt.de
Ich würde mich über Kommentare, Verbesserungen, Feedback allgemein freuen.
Im Anhang befinden sich neben weiterführender Literatur auch Grafikvorlagen für Overheadprojektoren.
Dieses Dokument darf (und soll sogar) nicht-kommerziell ganz oder in Teilen privat oder im Unterricht frei verwendet werden, solange der Autor (Florian Burckhardt) mitgenannt wird. Alle Rechte bleiben natürlich bei mir, eine kommerzielle Nutzung in Print- oder Elektronischen Publikationen (z.B. Online) ist ohne mein schriftliches Einverst”ndnis nicht erlaubt.
Inhalt:
Dieses Dokument gibt es auch als elodea.pdf (200KB) im Adobe Acrobat Format. Den Acrobat Reader gibt es bei Adobe.
I. Was ist Ökotoxikologie ?
Die Ökotoxikologie befaßt sich mit den Auswirkungen chemischer Schadstoffe auf den Einzelorganismus, auf Populationen und auf das gesamte Ökosystem. Sie dient der Risikoermittlung von Umweltchemikalien. Damit sind Stoffe gemeint, die durch menschliche Eingriffe in die Natur gelangen und dort vorher nicht oder nicht in diesen Konzentrationen vorhanden waren.
Zur Ermittlung des toxischen Potentials einer Umweltchemikalie werden standardisierte Biotests durchgeführt, mit denen man die Wirkung des Stoffes auf ausgewählte Organismen (z.B. Bakterien, Alge, Wasserfloh, Fisch) testet. Eine Standardisierung der Tests ist notwendig, um die Ergebnisse der verschiedenen Umweltchemikalien miteinander vergleichen zu können. Während der Testphase muß daher für konstante experimentelle Bedingungen gesorgt werden. Bei den Versuchen geht es nicht um die molekularbiologische Aufschlüsselung der Giftwirkung, sondern um den Einfluß der Substanzen auf verschiedene ökologische Parameter.
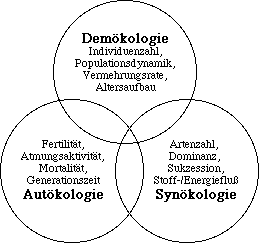
Gemessen werden in der Regel (Abb.1):
- autökologische Parameter (=bezogen auf das Individuum)
wie Fertilität, Mortalität, Generationszeit, Atmungsaktivität
- demökologische Parameter (=bezogen auf die Population)
wie Individuenzahl, Altersaufbau, Vermehrungsrate
- synökologische Parameter (=bezogen auf die Biozönose)
wie relative Artenzahl, Dominanz, Sukzession, Energiefluß
Abbildung 1: Meßparameter in der Ökotoxikologie
Ein Testorganismus soll repräsentativ, leicht kultivierbar und leicht zu handhaben sein. Man muß neben einem geeigneten Organismus auch geeignete Meßparameter wählen. Möchte man beispielsweise die Auswirkung eines Pestizides auf die Nahrungskette in einem eutrophen See bestimmen, so wählt man als Testorganismus am besten eine Alge stellvertretend für die Primärproduzenten und als Meßparameter die Vermehrungsrate, denn sie gibt an, wieviel Nahrung für die in der Nahrungskette nachfolgenden Konsumenten “produziert” werden kann.
Die Meßergebnisse eines bestimmten Versuches treffen meist nur für einzelne Organismengruppen zu. Ein Unkrautvertilgungsmittel wirkt z.B. auf einen Wasserfloh anders als auf eine Wasserpflanze.
Die Meßdauer richtet sich nach der Meßgröße. Für autökologische Parameter reichen meist ein paar Tage bis eine Woche aus, während demökologische und synökologische Parameter oft mehrere Wochen bis Jahre beanspruchen.
Bei der praktischen Durchführung eines Biotests setzt man die Testorganismen verschiedenen Konzentrationsstufen der Umweltchemikalie aus und bestimmt die Meßgröße in Abhängigkeit der Zeit. Dabei ist zu beachten, daß eine oder mehrere unbehandelte Kontrollen mitgeführt werden, deren Meßwerte bei der Auswertung als Vergleich dienen.
Ein weiterer wichtiger Aspekt ist die Bioverfügbarkeit eines Stoffes. Damit ist seine Eigenschaft gemeint, den Lebewesen tatsächlich zugänglich zu sein, sich also im Wasser zu lösen oder im Fettgewebe anreichern zu lassen. Problematisch ist dabei, daß die Bioverfügbarkeit von vielen Außenfaktoren wie Temperatur, pH, etc. abhängig ist. So können Schwermetalle beispielsweise in einem See an Tonsedimenten absorbiert sein und durch eine pH-Änderung abrupt freigesetzt werden.
zurück zum Anfang
II. Wie messe ich die Giftwirkung ?
Die Wirkung einer Umweltchemikalie läßt sich aufgrund der Variabilität der Testorganismen und der Testbedingungen häufig nur sehr schwer und zudem ungenau bestimmen. Die Frage: "Wieviel Gift brauche ich, um alle (100%) Wasserflöhe zu töten?" läßt sich nicht exakt beantworten.
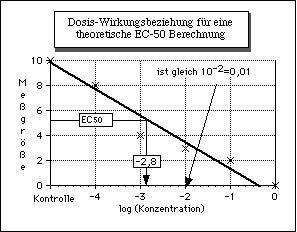
Daher verwendet man als typische toxikologische Kenngröße den EC50 Wert (EC=effective concentration). Er bezieht sich auf diejenige Schadstoffkonzentration, deren Meßwert halb so groß ist wie die der unbehandelten Kontrolle.
Der EC50 Wert wird graphisch bestimmt, indem die Meßgröße gegen die Stoffkonzentration aufgetragen wird.
Meistens liegen die Konzentrationsstufen jedoch mehrere Zehnerpotenzen auseinander. Eine lineare X-Achse wie etwa auf einem Zentimetermaß würde zu einer Häufung der Meßwerte um den Nullpunkt führen, da zwischen den Achsenmaßen 0 und 0,1 oft mehr Meßpunkte liegen als zwischen 0,1 und 1. Daher ist es allgemein üblich, anstelle der Konzentration den Logarithmus der Konzentration aufzutragen. Dadurch werden kleine Meßintervalle gegenüber den großen gespreizt. Anschließend legt man eine Gerade so durch die Punkte, daß jeder Punkt einen möglichst geringen Abstand von der Geraden hat. Bei der halben Wirkung gegenüber der Kontrolle (im Beispiel unten bei ca. Y=5) wird ein Lot auf die X-Achse gefällt. Zur Veranschaulichung ein Beispiel:
Von folgender Meßwerttabelle ausgehend
| Konzentration |
Meßwert |
| Kontrolle |
10 |
| 0.0001 |
8 |
| 0.001 |
4 |
| 0.01 |
3 |
| 0.1 |
2 |
| 1 |
0 |
ergibt sich für den Graphen der Dosis-Wirkungsabhängigkeit:
Abbildung 2: Dosis-Wirkungsbeziehung für eine theoretische EC50 Berechnung mit logarithmischer X-Achse. Der EC50-Wert kann durch ein Lot auf die X-Achse abgelesen werden. (=10-2,8 =1,6 x 10-3)
zurück zum Anfang
III. Der Elodea Ökotox-Versuch
Im folgenden Versuch wird die toxische Wirkung von Kupfersulfat (CuSO4) auf Elodea canadensis (kanadische Wasserpest) als Vertreterin der Wasserpflanzen getestet. Die Stoffwechselleistung der Pflanze wird in Form des photosynthetisch produzierten Sauerstoffs bei verschiedenen Kupfersulfatkonzentrationen gemessen.
Kupfersulfat ist ein blaues Schwermetallsalz und wird beispielsweise im Weinbau als Fungizid und Insektizid verwendet. Die toxische Wirkung geht vom Kupferion aus, welches als Schwermetallion die Tertiärstruktur (räumliche Anordnung) vieler zelleigenen Enzyme zerstört.
III.1 Versuchsaufbau und Zeitaufwand
Prinzipiell läßt sich mit diesem Versuchsaufbau eine Vielzahl von wasserlöslichen Stoffen testen, allerdings sollte man sich zumindest in der Schule auf solche beschränken, die für den Menschen (relativ) ungiftig sind und sich auch leicht beschaffen lassen.
Der Zeitaufwand beträgt je nach Umfang für die theoretische Vorbereitung etwa 20-40 Minuten, der Versuchsaufbau selbst kann je nach Vorarbeit in 15-30 Minuten erfolgen. Einmal aufgebaut, beansprucht der Versuch während seiner 4-5 tägigen Laufzeit täglich 5 Minuten, der Abbau geht ebenfalls schnell. Die Auswertung fällt je nach Umfang (Daten zusammenfassen, Graphen zeichnen, ausführliches Protokoll) zwischen 1 und 2 Stunden aus.
Unser Testorganismus, die kanadische Wasserpest Elodea canadensis, gehört zu den Froschbißgewächsen (Hydrocharidaceae) und wurde erst Mitte des vorigen Jahrhunderts aus Nordamerika bei uns eingeschleppt. Sie hat sich seitdem in unseren Flüssen und Seen stark ausgebreitet. Je nach Gewässerart kann sie über 50% der Bodenvegetation ausmachen. Die zweihäusige Pflanze kommt in Europa nur in der weiblichen Form vor und vermehrt sich durch Ableger (vegetative Vermehrung).
Abbildung 3: Bild von Elodea canadensis (kanadische Wasserpest): Unterwasserpflanze mit aufgerollten Blättchen, langer Sproß mit vielen kleinen Blättchen in Dreiergruppen. Foto aus Dreyer: Der Teich, Kosmos Naturführer
Elodea erfüllt alle Voraussetzungen für einen Modellorganismus:
Sie ist
- repräsentativ für die Gewässerflora
- einfach zu kultivieren
- experimentell leicht zu handhaben
- empfindlich gegenüber im Wasser gelösten Umweltgiften
Als Testparameter für die physiologische Leistung wird die Sauerstoffproduktion gewählt, die sich mit Hilfe der unten beschriebenen Konstruktion elegant messen läßt.
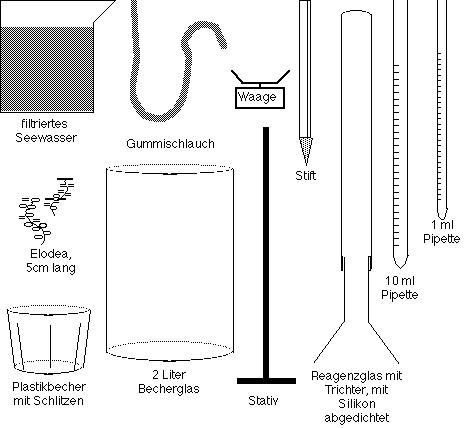
Material (siehe Abb. 4):
Wir verwenden 2 Kontrollen und 4 Verdünnungsstufen, das macht 6 Ansätze. Bei Materialmangel kann man auf eine Kontrolle und die 5x10-6 Stufe verzichten.
Benötigt werden (für 6 Ansätze):
- 6x 1 Liter filtriertes Seewasser (zum Filtrieren genügt ein Kaffeefilter)
- 6x vier 5cm lange Elodea-Stücke (möglichst aus demselben Gewässer wie das filtrierte Wasser)
- 6x ein 2 Liter Becherglas
- 6x ein kleiner, klarer Plastikbecher (z.B. einer für Wurstsalat aus der Metzgerei), an der Seite ca. 8 Schlitze ausschneiden
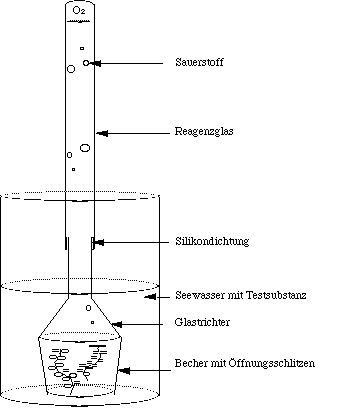
- 6x ein Reagenzglas, welches über Fugenkitt (Silikon o.ä.) mit einen Trichter luftdicht verbunden ist (s. Abbildung 3)
- 6x ein Stativ zum Befestigen der Reagenzgläser
- ein Gummischlauch zum Absaugen der Luft aus den umgekehrten Reagenzgläsern (Aquarienbedarf, Baumarkt)
- 1ml und 10ml Glaspipetten
- ein wasserfester Folienstift zum Anbringen der Markierungen
- eine Waage (Briefwaage bis 10g, Meßtoleranz 0,5g)
- Verdünnungsstufen von Kupfersulfat (siehe Tabelle)
Es ist wichtig, daß alle verwendeten Behältnisse klar sind, um das Licht durchzulassen.
Wir können von einer 100% Bioverfügbarkeit von Kupfer ausgehen, da sich CuSO4 gut in Wasser löst und Elodea während des gesamten Versuchs im Wasser bleibt. Kupfersulfat besitzt eine Molmasse von 159,5 [g/mol], liegt allerdings in der Gebrauchsform immer mit fünf Wassermolekülen assoziiert vor. Daher muß man mit M (CuSO4•5H2O)=249,5 [g/mol] rechnen (-> 250 [g/mol]).
Wir stellen uns zunächst eine 10-3 molare Stammlösung für unsere Konzentrationsreihe her: 0,001m CuSO4 = 0,25g auf einen Liter destilliertes Wasser. Die folgenden Volumenangaben für die Verdünnungsstufen werden erst nach Aufbau der Versuchsapparatur in die Bechergläser mit filtriertem Seewasser hinzupippetiert. Die Änderung des Gesamtvolumen durch die Zugabe von Stammlösung kann vernachlässigt werden.
| Verdünnungsstufe |
Volumen Stammlösung |
| 0,0000005m CuSO4 (5x10-7): |
0,5ml Stammlösung |
| 0,000001m CuSO4 (10-6): |
1ml Stammlösung |
| 0,000005m CuSO4 (5x10-6): |
5ml Stammlösung |
| 0,00001m CuSO4 (10-5): |
10ml Stammlösung |
| Kontrolle: |
keine Zugabe von Stammlösung |
Abbildung 4: Zubehör zur Durchführung des Elodea-Biotest
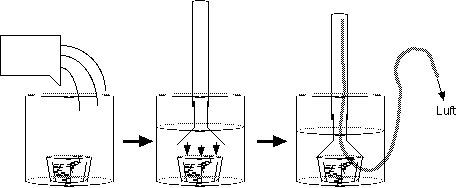
Durchführung und Versuchsaufbau (siehe Abb. 5):
Elodea wird in 5cm lange Stücke geschnitten, abgewogen und zu gleich vielen Teilen in die Plastikbecher der Kontrolle und der zu testenden Konzentrationen verteilt. Die Plastikbecher werden in die 2-Liter Bechergläser gestellt. Als Medium wird 1 Liter filtriertes Seewasser hinzugegeben. Über den Plastikgefäßen wird die Trichter-Reagenzglas Kombination aufgesetzt und mit einem Stativ fixiert. Die Luft in den Reagenzgläsern wird durch einen Schlauch abgesaugt. Anschließend wird die entsprechende Menge CuSO4-Stammlösung hinzupippetiert. Die Versuchsanordnung wird mit Hilfe von Stativen stabilisiert und anschließend bei möglichst konstanter Temperatur und Beleuchtung (Schulklasse Fensterbank) fünf Tage stehengelassen. Wichtig ist, daß alle Bechergläser denselben Bedingungen (Temperatur, Licht) ausgesetzt sind.
Abbildung 5: Versuchsaufbau:
- Seewasser in Becherglas eingießen und abgemessene Elodea Stücke in Plastikbecher legen.
- Trichter mit Reagenzglas über Plastikbecher stülpen und fixieren.
- Luft über Reagenzglas absaugen, so daß Reagenzglas vollständig mit Wasser gefüllt ist.
- der Verdünnungsreihe entsprechend die Stammlösung hinzupippetieren
Laufender Versuch (siehe Abb. 6)
Der produzierte Sauerstoff steigt in Form von Gasbläschen auf und wird mit Hilfe des Trichters aufgefangen. Der Pegelstand wird 4-7 Tage lang täglich zur gleichen Uhrzeit auf dem Reagenzglas markiert.
Mit viel Gasbildung ist vor allem in den Kontrollen und den niedrigen Konzentration zu rechnen (weniger Gift -> weniger Hemmung). Man benutzt daher in diesen Gefäßen entweder größere Reagenzgläser, oder man saugt rechtzeitig die Luft ab und markiert mit einer anderen Farbe weiter.
Abbildung 6: Laufender Versuch: produzierte Luft steigt auf und verdrängt Wasser im Reagenzglas
zurück zum Anfang
III.2 Auswertung
Sauerstoffmessung:
Nach Beendigung des Versuchs werden die kopfstehenden Reagenzgläser nach Markierung des Pegelstandes aus der Apparatur entnommen. Die produzierte Sauerstoffmenge für jeden Tag wird durch Pipettieren von Wasser bis zur Markierung des nächsten Tages bestimmt und in eine Tabelle eingetragen. Dabei entspricht das Wasservolumen in ml der täglich produzierten Sauerstoffmenge. Beispiel:
- Versuchsdauer: Montag bis Freitag, d.h. Dienstag erfolgt die erste "Pegelmarkierung" und Freitag die letzte
- Volumen(Montag) = Differenz zwischen Wasserstand(Dienstag) und Wasserstand(leeres Reagenzglas)
- Volumen(Dienstag) = Differenz zwischen Wasserstand(Mittwoch) und Wasserstand(Dienstag)
- Volumen(Mittwoch) = Differenz zwischen Wasserstand(Donnerstag) und Wasserstand(Mittwoch)
- Volumen(Donnerstag) = Differenz zwischen Wasserstand(Freitag) und Wasserstand(Donnerstag)
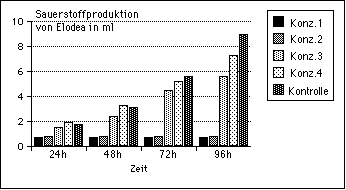
Die Sauerstoffproduktion wird für jede Konzentration in Abhängigkeit der Zeit aufgetragen, um den zeitlichen Verlauf der Giftwirkung zu zeigen (Abb. 7).
Abbildung 7: Sauerstoffproduktion von Elodea in verschiedenen Konzentrationen und nach bestimmten Zeitpunkten
Der EC50 Wert wird aus den bis zum Versuchsende (Abb. 7: nach 96 Stunden) gebildeten Gasmengen bestimmt. Dazu wird auf der y-Achse die Sauerstoffmenge und auf der x-Achse der Logarithmus der Kupferkonzentration aufgetragen. Anschließend wird, wie weiter oben beschrieben, bei der halben Sauerstoffmenge der Kontrolle das Lot auf die x-Achse gefällt. Nach der Umwandlung der logarithmisierten Konzentration durch Potenzieren ("10 hoch X-Wert") erhält man die Konzentration an Kupfersulfat, bei der die Sauerstoffproduktion von Elodea um 50% reduziert wird.
In unseren Laborversuchen erhielten wir für den EC50 von Kupfersulfat einen Wert von 2,4 x 10 -6 [mol/l] CuSO4. Dieser Meßwert soll allerdings nur als Richtgröße dienen, d.h. jede Konzentration in der Größenordnung 10 -6 [mol/l] bewegt sich innerhalb der Toleranz.
zurück zum Anfang
III.3 Diskussion
Am Beispielgraphen (Abb. 7) fällt zunächst auf, daß die Pflanzen der beiden höchsten Kupferkonzentrationen lediglich am ersten Tag eine kleine Menge Sauerstoff produzieren konnten, bevor sie totalgehemmt wurden. Kupfer wirkt also aus Wasserpflanzen mit einer kleinen Verzögerung.
Der EC50 Wert für Elodea canadensis lag bei unseren Labormessungen bei 0,0000024 [mol/l] CuSO4. Das entspricht 1 Gramm Kupfersulfat auf ca. 1700 Liter. Demzufolge ließe sich die gesamte Vegetation eines 20m3 Gartenteiches bereits durch 12g Kupfersulfat (Gewicht von 2 Zweimarkmünzen) erheblich beeinträchtigen, von der Auswirkung auf andere Wasserorganismen einmal abgesehen. Beispielsweise hatte CuSO4 in unseren Laborversuchen bereits ab 0,000001 [mol/l] (1g auf 4000 l) eine absolut tödliche Wirkung auf den Wasserfloh Daphnia pulex, welcher ein typischer Vertreter von Zooplankton ist.
EC50-Werte dürfen nicht isoliert betrachtet werden; eine Beinträchtigung von Wasserpflanzen alleine wäre ja auch evtl. noch zu verkraften. Erst durch vernetztes, ökologisches Denken werden die Folgen einer solchen Beeinträchtigung deutlich.
Betrachtet man eine einfache aquatische Nahrungskette (siehe Abb. 8) aus Wasserpflanzen und Phytoplankton (Primärproduzenten), Zooplankton (Konsumenten 1. Ordnung) und planktivoren Fischen (Konsumenten 2. Ordnung), dann hat eine 50% Stoffwechselhemmung der Primärproduzenten zur Folge, daß alle höhere Trophieebenen ebenfalls nur noch halbsoviel Energie zur Verfügung haben wie vorher. Gerade die vielen individuenarmen Populationen in oligotrophen (seltene nähstoffarme) Seen könnten dadurch unter ihr Existenzminimum gebracht werden und absterben. Zudem werden die Gifte in der Nahrungskette angereichert und lagern dort als biologische Zeitbombe.
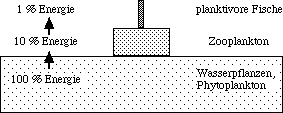 |
Abbildung 8: Energiefluß in einem einfachen aquatischen Ökosystem mit 90% Energieverlust zwischen den Trophieebenen
Anhang
Mit weiterführender Literatur und Overhead "Gifs".
Autor: Florian Burckhardt, der jetzt ziemlich müde ist (23:25) und gleich beim Nick 'nen Kaffee bestellt.